近日,北京市神经外科研究所谢微嫣教授和刘春晖教授团队在Clinical and Translational Medicine期刊上发表了题为Comprehensive mapping of somatotroph pituitary neuroendocrine tumour heterogeneity using spatial and single-cell transcriptomics的研究文章。该研究利用10x空间转录组(STRNA-seq)和10x单细胞转录组(ScRNA-seq)等方法研究了垂体神经内分泌肿瘤(PitNETs)的细胞组成和空间异质性,为理解肿瘤进展所涉及的关键机制提供了坚实的理论基础,并为开发治疗生长激素型PitNETs的提供了依据。
安诺优达有幸为本研究提供了10x空间转录组的建库测序和定制化分析服务。安诺优达资深生信工程师(副研究员)为本文共同作者。

 研究背景
研究背景
PitNETs是复杂且常见的颅内肿瘤。生长激素分泌型PitNETs可导致肢端肥大症,治愈困难。PitNETs具有不同细胞类型和生长模式,可表现侵袭性,导致高复发率和治疗抵抗。因此,对PitNETs的细胞组成和空间异质性进行全面分析,将有助于识别有效靶点并阐明肿瘤进展的机制。
 研究材料
研究材料
10x单细胞转录组:4例正常样本,16例生长激素型PitNETs样本;
10x Visium Cytassist空间转录组:2例正常样本,2例生长激素型PitNETs。
 实验思路
实验思路
 研究结果
研究结果
01 / 生长激素型PitNETs和正常垂体的异质性景观
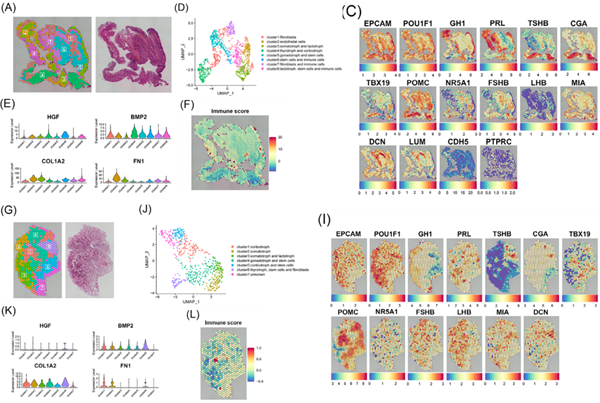
作者对2个生长激素型PitNETs样本(T1和T2)以及2个正常垂体样本(N1和N2)进行STRNA-seq。通过对肿瘤样本注释,鉴定出了上皮细胞、生长激素细胞、成纤维细胞、免疫细胞等细胞群(图1C和D)。与正常样本相比,T2肿瘤样本中各类细胞表达的与肿瘤侵袭性和血管生成相关的促瘤因子水平更高(图1E)。免疫评分的结果表明生长激素型PitNETs样本中存在免疫细胞浸润(图1F)。对正常垂体样本注释,得到了上皮细胞、生长激素细胞、成纤维细胞等细胞群(图1I和J)。在N2样本中,与肿瘤侵袭性和血管生成相关的基因表达水平较低(图2K),且免疫评分也相对较低(图2L)。这是首次在空间维度上直观地展示生长激素型PitNETs和正常垂体的细胞多样性和免疫状态。
02 / 生长激素型PitNETs与正常组织中差异基因的空间表达特征
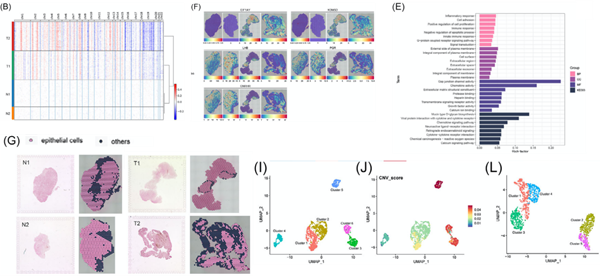
作者基于肿瘤与正常组织样本,推导了拷贝数变异(CNVs),其结果与病理诊断相吻合,肿瘤样本展现出更高的CNV评分及多样性模式,揭示了肿瘤内部的基因组异质性(图2B、C)。随后,作者分析了正常垂体和肿瘤组织的差异表达基因(DEGs),发现EIF1AY和KDM5D在肿瘤中显著上调,而在正常垂体中几乎不存在;而LHB和PGR在正常样本及瘤周区域高表达,但在肿瘤区域内表达相对较低(图2F)。上调的DEGs主要富集在炎症反应、细胞黏附和细胞增殖正调控等过程中(图2E)。
鉴于上皮细胞在所有样本中占比最高,作者深入比较了肿瘤组织与正常组织中上皮细胞的空间分布和DEGs的差异(图2G)。在肿瘤组织的上皮细胞区域识别出6个CNV水平显著不同的cluster,其中cluster 5的CNV水平最高(图2I和J)。而在正常组织的上皮细胞区域,获得了5个cluster(图2L)。此外,作者还发现成纤维细胞也具有高度异质性。
03 / 空间CNV揭示生长激素型PitNETs瘤内异质性
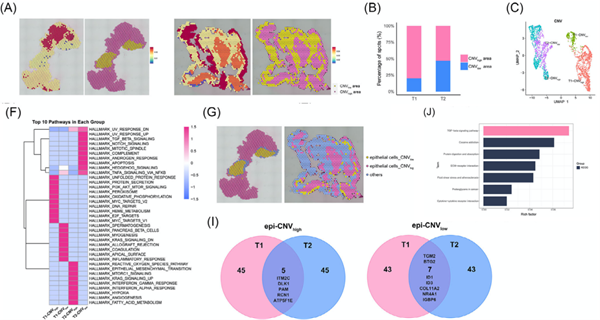
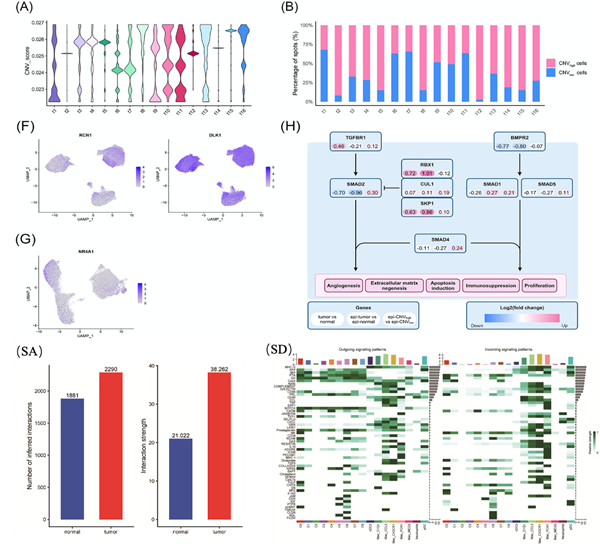
作者利用空间CNV分析界定了CNVhigh区和CNVlow区,与病理学判定的肿瘤与癌旁区域相吻合(图3A)。肿瘤样本的CNVhigh区和CNVlow区的比例及CNV水平存在差异,反映了肿瘤间存在较高的异质性(图3B和C)。T2样本的CNVhigh区显示异质性更高,GSVA分析进一步揭示了不同样本及区域间的显著差异(图3F)。鉴于上皮细胞在肿瘤中占比较大,作者将其分为epi-CNVhigh和epi-CNVlow区(图3G)。通过对T1和T2样本前50个DEGs的交集分析,发现ITM2C、DLK1、PAM、RCN1和ATP5F1E基因在epi-CNVhigh区高表达,而TGM2、BTG2、ID1、ID3、COL11A2、NR4A1和IGBP6基因在epi-CNVlow区富集(图3I)。Transwell实验和免疫组化实验结果表明DLK1和RCN1可能具有促进肿瘤进展的作用。KEGG富集分析则揭示了上皮细胞与TGF-β信号通路之间存在的密切联系(图3J)。
04 / 生长激素型PitNETs与正常组织的单细胞转录组图谱
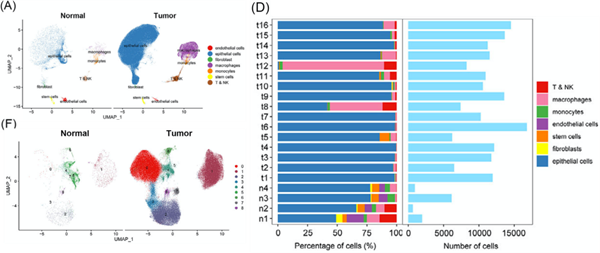
接下来,作者对4个正常垂体样本(n1-n4)和16个生长激素型PitNETs样本(t1-t16)进行ScRNA-seq。分析结果显示,单细胞数据与空转数据在主要细胞类型的识别上保持一致,但差异在于免疫细胞,尤其是巨噬细胞的数量显著增多(图4A)。除了t12主要由巨噬细胞占主导外,其余样本均以上皮细胞为主要构成。正常垂体中的细胞类型更丰富且相似,而肿瘤组织中不同细胞类型的比例差异很大(图4D)。在正常组织中,上皮细胞主要由第5簇主导(图4F)。此外,LHB、GNRHR、TGFBR3L、FOSB和SCGN基因在正常垂体上皮细胞中呈现高表达,而在肿瘤上皮细胞中的表达则较低。进一步对髓系细胞的分析发现,肿瘤样本中Mac_MEG3簇的比例显著增加,而Mac_FCN1和Mac_CCL3簇在正常样本中占主导地位。
05 / 生长激素型PitNETs上皮细胞的转录异质性
为了探究肿瘤组织中不同上皮细胞对生长激素型PitNETs的发生和发展的促进作用,作者根据ScRNA-seq中上皮细胞的CNV水平,划分为epi-CNVhigh和epi-CNVlow区,且不同肿瘤样本中epi-CNVhigh的比例存在差异图(5A和B)。进一步分析显示,RCN1和DLK1在epi-CNVhigh中高表达,而NR4A1在epi-CNVlow中高表达(5F和G)。此外,瘤内TGF-β信号通路基因的表达呈现异质性(图5H)。利用Cellchat2分析,作者发现肿瘤样本中上皮细胞与髓系细胞间的通讯数量和强度高于正常样本(图SA),且两者之间存在多个显著差异途径。生长激素信号通路在肿瘤组织中高度活跃,且巨噬细胞中的Mac_MEG3为该通路的主要信号通路(图SD),表明生长激素的分泌与该细胞群密切相关。这些发现表明,生长激素型PitNETs中存在一种特殊的免疫应答模式。
 研究总结
研究总结
该研究利用STRNA-seq和ScRNA-seq等方法研究了PitNETs的细胞组成和空间异质性,发现肿瘤原基因DLK和RCN1可能与肿瘤进展有关,可作为后续治疗的靶点,同时还发现TGF-β信号通路参与肿瘤进展,并确定了关键基因表达谱的特性。该研究为了解生长激素型PitNETs进展的关键机制和开发治疗提供了强有力的理论依据。

