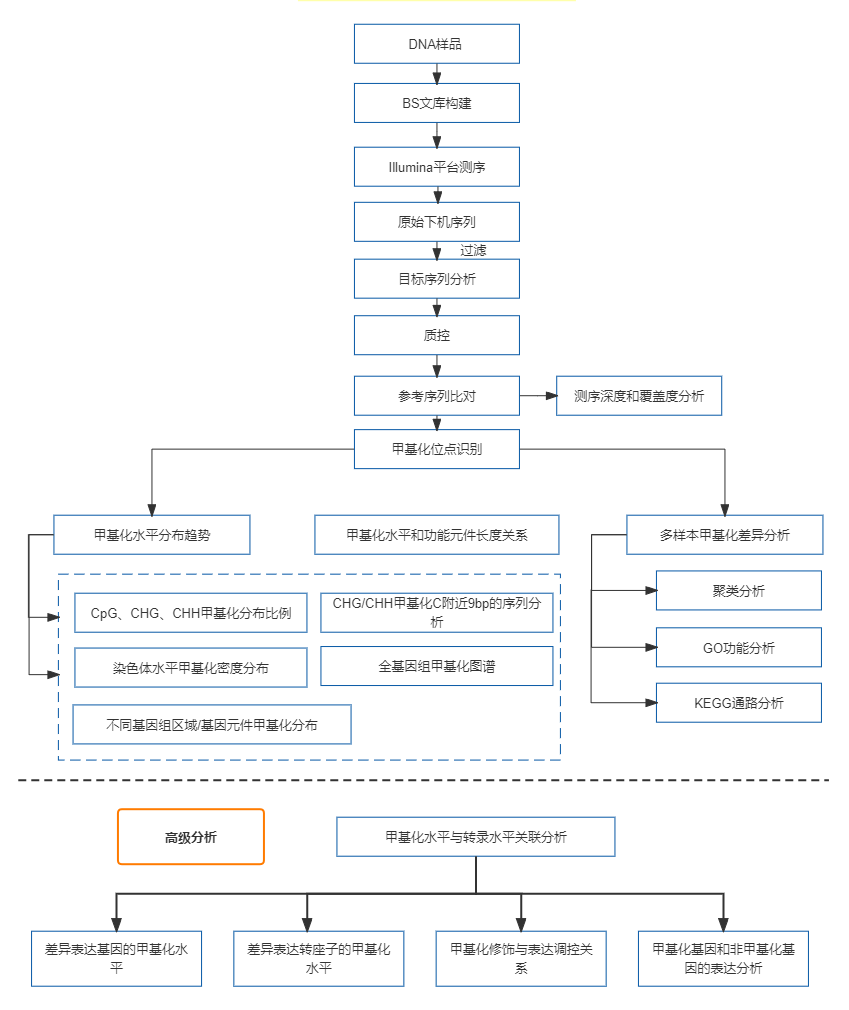
DNA甲基化是重要的表观遗传学标记信息,获得全基因组范围内所有C位点的甲基化水平数据,对表观遗传学的时空特异性研究具有重要意义。Bisulfite甲基化测序是以新一代高通量测序平台为基础,结合全基因组Bisulfite处理和生物信息数据分析技术,进行低成本、高准确度的全基因组DNA甲基化水平图谱绘制。
项目经验
物种经验30+,合作单位100+
建库技术
50ng低起始量建库
多样化生信分析
标准分析、多组学联合分析、定制化分析
项目周期
60天完成建库测序及标准分析
胚胎发育
果实发育与成熟
品质形状调控
器官衰老
肿瘤标志物
衰老过程
疾病调控
肝线粒体ND6的高甲基化引起全身胰岛素抵抗
Hypermethylation of Hepatic Mitochondrial ND6 Provokes Systemic Insulin Resistance
期刊:Advanced science 发表时间:2021.5 影响因子:16.801 合作单位:西安交通大学
线粒体表观遗传学因其与衰老和疾病密切相关,所以日渐受到关注。本研究显示,在13个线粒体DNA (mtDNA)编码基因中,NADH-脱氢酶6 (ND6)转录本主要在肥胖和2型糖尿病人群中减少,这与其独特的高甲基化呈负相关。小鼠肝脏mtDNA测序揭示,ND6呈现最高的甲基化水平,在糖尿病条件下,由于游离脂肪酸通过AMPK的激活促进的DNA甲基转移酶1 (DNMT1)的线粒体易位,使得ND6 甲基化水平显著增加。在小鼠肝脏中敲降 ND6 或过表达 Dnmt1 同样会损害线粒 体功能,并在体内和体外诱导胰岛素抵抗。相关实验也证实了靶向肝DNMT1对抗胰岛素抵抗相关代谢紊乱有显著益处。本研究证实了 ND6表观遗传网络在调节线粒体功能和胰岛素抵抗发病中的关键作用,从线粒体表观遗传的角度阐明了胰岛素抵抗和相关代谢紊乱的潜在预防和治疗策略。
ND6 在肥胖者中表达量降低:qPCR
ND6 在肥胖者中甲基化水平提高:甲基化特异性 PCR
ND6 是小鼠模型中甲基化水平最高的线粒体基因:WGBS
ND6 敲降效果&引起的差异基因变化和胰岛素转导途径关联:RNA-seq
DNMT1 与 ND6 结合:MtDIP(mtDNA 免疫沉淀)
人外周血白细胞中ND6高甲基化是T2DM(2型糖尿病)的一个独特生物标志物
肥胖是引起2型糖尿病(T2DM)的主要因素,本研究分析了 GTEx项目中的的在线数据, 发现ND6是肥胖受试者中下调最显著的基因,说明ND6可能是肥胖最敏感的生物标志物之一,且参与T2DM的发展。为了进一步明确临床特征,收集T2DM队列临床样本和对照组中外周血白细胞,以进一步探究ND6在T2DM中的作用。结果显示,两组mtDNA 的拷贝数没有差异,ND6的表达在T2DM中显著降低。mtDNA相关转录因子表达无明显差异。继续通过甲基化特异性PCR分析外周血白细胞中ND6的甲基化水平,结果显示ND6在T2DM组中的甲基化水平显著升高,且和基因表达呈负相关,和胰岛素抵抗程度呈 正相关。综上所述,外周血白细胞中ND6甲基化的增加可能是T2DM的一个独特的预测因子。
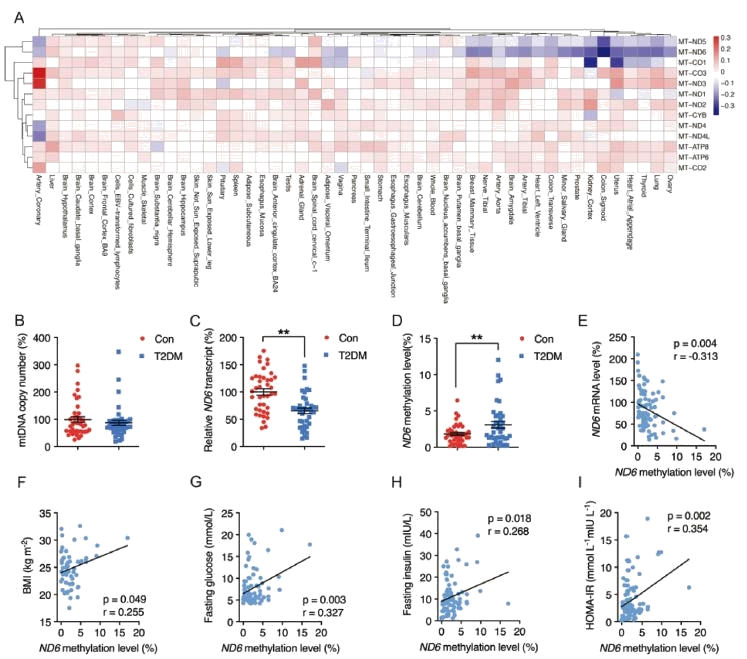
图1 mtDNA相关基因表达情况和甲基化情况
ND6是胰岛素抵抗型小鼠肝脏mtDNA甲基化的主要靶点
鉴于肝脏在胰岛素抵抗中的核心作用,本研究探讨了肝脏ND6甲基化在代谢紊乱中的作用。
动物模型构建:采用HFD(高脂肪饮食)诱导的胰岛素抵抗小鼠和db/db小鼠(2型糖尿病小鼠)作为肝脏胰岛素抵抗的动物模型。
对小鼠模型肝脏中mtDNA进行全基因组甲基化测序。结果显示,mtDNA两条链上总体甲基化修饰频率较低,两条链上甲基化修饰不对称,HFD组的L链区域呈现较多的CHH甲基化修饰,db/db的L链呈现较多的CG、CHG甲基化修饰。
为了进一步评估编码肽的13个mtDNA基因的差异甲基化模式,分析了对照组和HFD组的平均CHH甲基化频率,结果显示位于L链的CHH修饰频率在ND2、ND5、ND6、COX1、ATP8基因上显著升高。db/db小鼠的L链上ND1、ND6、CYTB、COX1基因上CG型甲基化水平增加,ND2、ND6、COX1基因上CHG型甲基化水平增加。综上,ND6 是 mtDNA中甲基化修饰水平最高的基因,下调ND6导致胰岛素抵抗小鼠肝脏中复合物1 活性降低,表明ND6在维持复合物1活性中起着关键作用。
此外,HOMA-胰岛素抵抗指数和 L链上ND6甲基化呈现正相关,说明了ND6甲基化在胰岛素抵抗过程中的重要作用。

图2 ND6是高脂饮食(HFD)诱导胰岛素抵抗小鼠肝脏mtDNA甲基化的主要靶点
敲降ND6导致线粒体功能障碍和胰岛素抵抗(ND6功能验证)
通过体内和体外敲降,证实ND6在胰岛素抵抗中的调节作用。
体外敲降ND6损害了HepG2细胞中线粒体耗氧率功能和胰岛素敏感性,和3T3-L1和HT22细胞敲降ND6引起线粒体超氧化物水平增高结果一致。
体内敲降:敲降小鼠模型肝脏中的ND6显著降低复合物1活性,大大提高了肝脏中线粒体羰基蛋白水平。透射电镜显示敲降ND6使得小鼠肝脏中线粒体破碎且方向混乱,脂质沉积轻微增加。
线粒体功能受损和胰岛素抵抗密切相关,口服葡萄糖耐量实验也证实了ND6敲降引起胰岛素敏感性降低。为了确保ND6敲降的效果,对肝脏样本进行RNA-seq,鉴定了336个差异基因,这些基因显示出与胰岛素相关的转导相关途径的强关联,而胰岛素相关的调节网络没有直接变化。

图3 ND6功能验证
线粒体DNA甲基转移酶1(DNMT1)促进肝脏ND6高甲基化(ND6高甲基化机制
探究)
进而探究ND6甲基化的上游调控网络。亚细胞定位显示,在胰岛素抵抗小鼠模型中,肝脏DNMT1的线粒体定位显著增加,免疫荧光成像和WB显示野生型DNMT1的过度表达促 进了HepG2细胞中线粒体和细胞核的定位。
过表达DNMT1,而后通过mtDIP揭示了DNMT1与mtDNA D环和ND6区的结合显著增加,ND6 mRNA的表达显著降低。
为了探索DNMT1介导的ND6表达和胰岛素信号在体内的作用,构建过表达Dnmt1并带有荧光标记的的载体并导入野生型小鼠中。结果显示绿色荧光蛋白在肝脏中的主要表达,12天后Dnmt1的mRNA和蛋白质水平均显著上调,体重、肝脏、其他器官重量均无明显变化,此外在注射非线粒体靶向Dnmt1载体的小鼠中,Dnmt1也倾向于线粒体易位。因此,在不影响mtDNA拷贝数和其他nDNA编码亚基的情况下肝脏ND6甲基化水平增加,ND6表达降低,复合物1的活性被抑制,甘油三酯在肝脏中沉积率增加。与直接肝脏ND6敲除一致,Dnmt1过表达充分损害了小鼠的葡萄糖耐量和胰岛素敏感性,Akt信号被进一步抑制。综上,DNMT1可以对ND6甲基化和转录进行直接调节,这在线粒体功能障碍相关的肝胰岛素抵抗中有重要的作用。
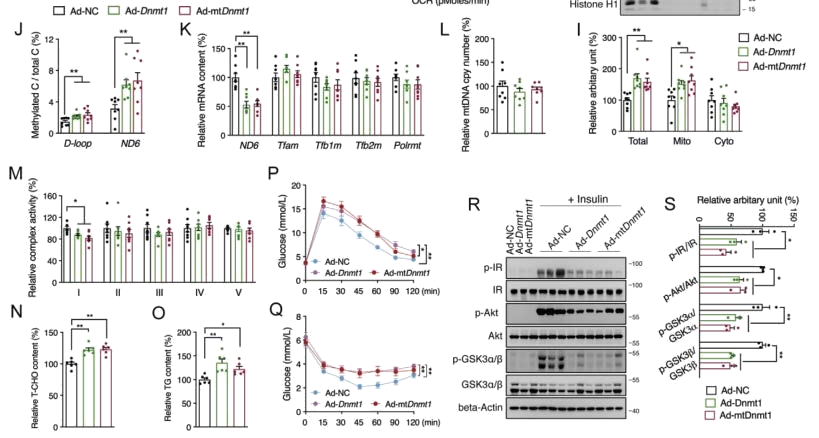
图4 mtDNMT1促进肝脏ND6高甲基化进而引发胰岛素抵抗
游离脂肪酸通过激活 AMPK促进DNMT1向线粒体转移(ND6高甲基化机制探究)
富含游离脂肪酸是HFD引起脂肪肝和胰岛素抵抗的主要原因,因此推测 DNMT1是肝脏病理过程中游离脂肪酸的有效靶点。在短时间棕榈酸(PA)处理后,在HepG2细胞和小鼠原代肝细胞中都观察到DNMT1的线粒体易位增强,提示DNMT1介导的ND6高甲基化是线粒体功能障碍和胰岛素抵抗发作期间的早期事件。
DNMT1抑制剂显著降低了由PA诱导的DNMT1与mtDNA ND6和D环区结合的升高,降低了ND6和D环甲基化水平,改善 了ND6表达、线粒体OCR能力、胰岛素敏感性。敲低HepG2细胞中的DNMT1使 ND6 恢复转录。综上,PA诱导的线粒体功能障碍和胰岛素抵抗是通过促进线粒体中DNMT1的活性来实现的。
AMPK、MAPK与PA诱导的胰岛素抵抗密切相关,因此我们推断某些激酶在短时间内参与了PA促进的DNMT1易位。使用PA处理HepG2细胞,AMPK和Akt磷酸化在2h内有效升高。
为了证实AMPK在 PA调节的DNMT1线粒体易位中的作用,使用AMPK激活剂处理HepG2细胞,在 4小时内有效促进DNMT1线粒体定位,随后在24小时内增加ND6甲基化水平并降低ND6 mRNA水平,而不影响mtDNA拷贝数和相关转录因子。与此同时,AMPK抑制剂逆转了ND6 的甲基化和mRNA的低表达。Akt激活剂处理后无明显变化,说明Akt可能不是DNMT1介导的ND6高甲基化的主要上游调节因子。
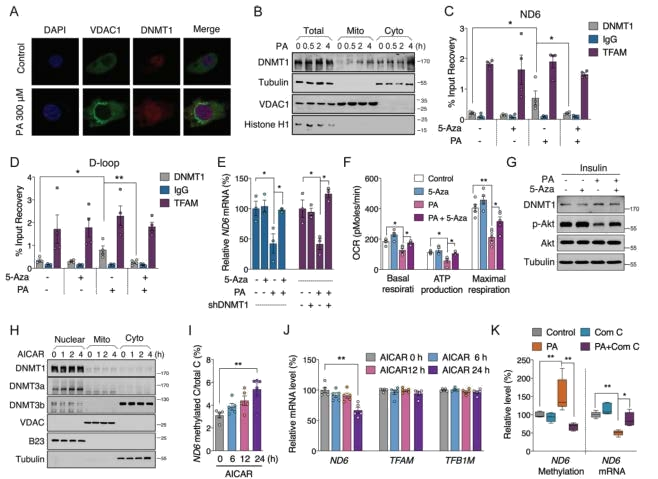
图5 棕榈酸 (PA) 通过与 DNMT1 相关的 ND6 高甲基化诱导肝脏胰岛素抵抗
抑制DNMT1可恢复胰岛素抵抗小鼠的ND6表达并改善胰岛素敏感性(相关应用探究)
敲降小鼠肝脏DNMT1,ND6甲基化恢复正常,ND6 mRNA的含量、复合物1、复合物2 活性均升高,小鼠体重降低,肝脏脂质沉积减少,这表明了一种独特的复杂活性表观遗传调控。对胰岛素信号通路相关基因进一步分析,显示胰岛素刺激后p-IR、 p-Akt、p-GSK3 的水平恢复正常。肝脏Dnmt1敲除未能改善HFD诱导的空腹胰岛素升高,表明DNMT1 主要参与胰岛素敏感性调节。所以我们可以通过靶向肝脏DNMT1来全身改善代谢紊乱。在HFD和db/db胰岛素抵抗动物中采用甲基化抑制剂进行治疗,结果显示随着甲基化水平的降低,ND6转录水平增强,肝脏脂质沉积和胰岛素敏感性也得到改善。综上,ND6甲基化在胰岛素抵抗发病中起着关键作用,因此,靶向其表观遗传网络治疗胰岛素抵抗和2 型糖尿病是可行的。
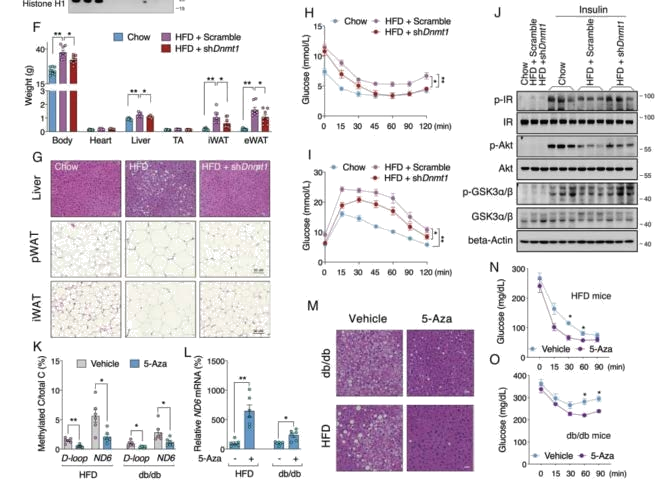
图6 DNMT1 的抑制可恢复 ND6 表达并改善胰岛素抵抗小鼠的胰岛素敏感性
[1] Cao K , Lv W , Wang X , et al. Hypermethylation of Hepatic Mitochondrial ND6 Provokes Systemic Insulin Resistance[J]. Advanced Science, 2021.