2023年9月,首都医科大学附属北京妇产医院岳文涛教授团队在Clinical and Translational Medicine(IF=10.6)上发表题为“Single-cell transcriptomics identify TNFRSF1B as a novel T-cell exhaustion marker for ovarian cancer”的研究论文。该研究对卵巢癌及正常卵巢进行单细胞转录组测序,探索了卵巢癌中T细胞的耗竭情况,深入挖掘了能预测T细胞耗竭的新型标志物及其相关机理。研究团队绘制了正常卵巢、交界性卵巢癌及高级浆液性卵巢癌的单细胞图谱,揭示了各种组织类型中T细胞的数量及特征,通过比较CD8+耗竭T细胞和CD8+效应T细胞的转录组谱系,进一步筛选出与T细胞耗竭密切相关的基因TNFRSF1B,体内外实验均证明了TNFRSF1B通过抑制IFN-γ表达促进肿瘤的进展。安诺优达为本文的合作作者,提供了10× 单细胞建库测序和分析服务。
研究背景
多项研究结果显示免疫疗法可改善肿瘤治疗效果,但由于复杂的肿瘤微环境,癌症患者对免疫治疗常表现出不同的反应。大量临床研究显示多数卵巢癌患者对PD-1抗体等治疗方式产生抵抗或无反应,疗效不佳。因此,迫切需要一个更有效的癌症衰竭靶点来提高患者的生存率。因此,了解肿瘤微环境中不同免疫细胞类型对于开发新的治疗策略至关重要。
研究思路
研究结果
01 卵巢癌的单细胞图谱及其T细胞特征
对高级浆液性卵巢癌、正常卵巢及癌症交界处进行单细胞转录组测序(scRNA-seq),通过聚类分群和marker基因进行注释,共鉴定到9个不同的细胞类型;大规模拷贝数变异(CNVs)数据显示,高级浆液性卵巢癌细胞中的上皮细胞和成纤维细胞具有更高的CNV水平,证实了肿瘤微环境中细胞多样性和恶性细胞类型。在癌症样本中TC1亚簇在T细胞中优先富集并占主导地位,且具有显著的衰竭特征。RNA速率分析揭示了耗竭T细胞的可能分化来源(Tcm到Teff再到Tex)。基因集富集分析显示,TC1亚簇由耗竭的CD8+T细胞组成。
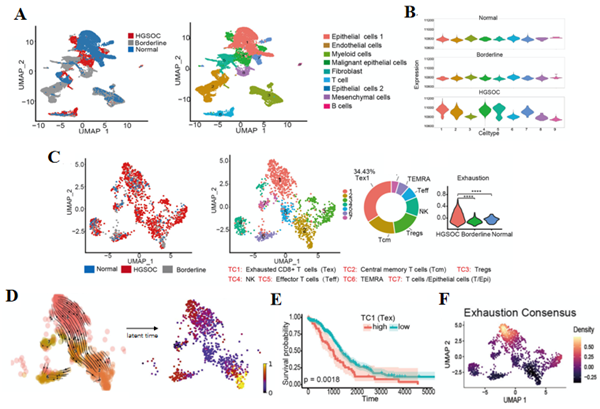
02 筛选出与T细胞耗竭密切相关的基因TNFRSF1B
通过比较耗竭T细胞和效应T细胞中的转录组信息,筛选出在耗竭T细胞中高表达的TNFRSF1B。TNFRSF1B在CD8+T细胞和Tregs上高度表达,并表明TNFRSF1B可能是T细胞耗竭标志物,并且高表达TNFRSF1B与预后不良有关。免疫荧光染色实验证实卵巢癌患者中CD8+TNFRSF1B+簇的存在。
scRNA-seq数据显示,在肿瘤中的Tregs和衰竭的T细胞中均存在高表达的TNFRSF1B模式。高表达CD8+TNFRSF1B的T细胞产生的IFN-γ明显少于低表达CD8+TNFRSF1B的T细胞,说明TNFRSF1B在CD8+T细胞中发挥抑制作用。TNFRSF1B与PD-1和LAG-3具有高度相关性,TNFRSF1B+T细胞类型在多种类型的T细胞中都有表达,意味着TNFRSF1B是卵巢癌免疫治疗的潜在可靠靶点。

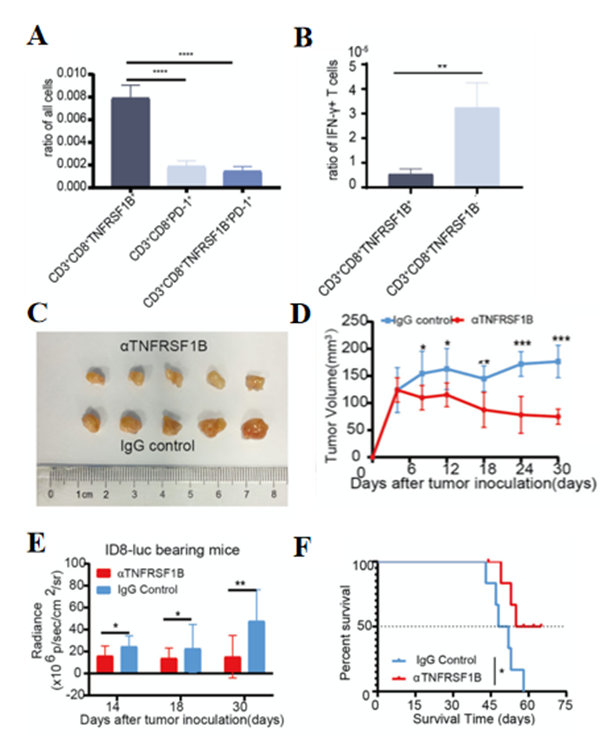
03 体内外实验证明TNFRSF1B的高表达能抑制IFN-γ的产生
在140例卵巢癌临床样本中,与黏液性和内膜样肿瘤相比,浆液性肿瘤中CD3+CD8+TNFRSF1B+T细胞的比例更高。此外,CD3+CD8+TNFRSF1B+T细胞产生较低的IFN-γ,CD3+CD8+TNFRSF1B+T细胞的高比例与恶性组织学类型、更差的总体生存率以及PD-L1和Ki67的表达相关。表明CD3+CD8+TNFRSF1B+T细胞可能在卵巢癌进展中发挥潜在作用,并可用作临床恶性指标。
在使用抗TNFRSF1B抗体治疗荷瘤小鼠后,抑制了肿瘤生长和转移,腹水体积和腹部周长显著减少。这些发现强调了靶向TNFRSF1B在卵巢癌治疗中的潜力。TNFRSF1B抗体可以通过影响T细胞反应和逆转荷瘤小鼠的免疫抑制来减轻肿瘤负担。实验结果再次证明了TNFRSF1B在抑制卵巢癌中肿瘤生长中的关键作用。
结论
本研究使用卵巢癌和正常卵巢的单细胞转录组数据,探索卵巢癌中T细胞的耗竭情况,深入挖掘了能预测T细胞耗竭的新型标志物及其相关机理。
该研究绘制了高级浆液性卵巢癌的单细胞图谱,描绘了其抑制性的肿瘤微环境,并在浸润的T细胞中发现一群高表达TNFRSF1B的CD8+耗竭T细胞,介导不良预后,该结果在140例卵巢癌临床样本中得到证实;随后,该团队通过体内外实验证明TNFRSF1B的高表达能抑制IFN-γ的产生;在使用抗TNFRSF1B抗体治疗荷瘤小鼠后,能显著抑制小鼠体内卵巢癌进展。
本研究有助于深入了解T淋巴细胞耗竭的机制,并可进一步以TNFRSF1B为干预靶点,发展新的免疫治疗方法,为卵巢癌患者的治疗提供新的思路。

