近日,广州医科大学附属妇女儿童医疗中心的刘慧姝教授和冀开元团队在Biomarker Research(IF=11.1)期刊上发表了题为Single-cell and spatial transcriptomics reveal alterations in trophoblasts at invasion sites and disturbed myometrial immune microenvironment in placenta accreta spectrum disorders的研究文章。该论文利用10x 单细胞转录组和10x 空间转录组等方法,研究了胎盘植入微环境中子宫肌层受到滋养细胞侵袭时所发生的转录表达变化,揭示了胎盘植入中的细胞各组分差异基因以及细胞间通讯的变化。
安诺优达有幸为本研究提供了10x 单细胞转录组(ScRNA-seq)和10x 空间转录组(STRNA-seq)的建库测序和标准分析服务。


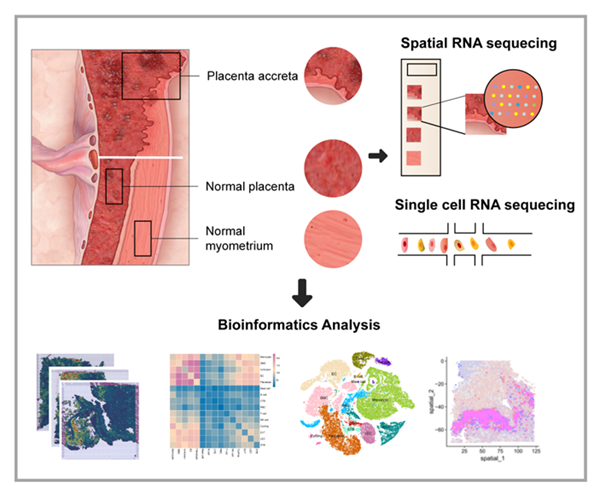
胎盘植入性疾病(PAS)以胎盘异常附着及侵入子宫肌层为特征的疾病,是导致孕期子宫破裂、严重产后出血,甚至母婴死亡等并发症的重要原因。胎盘植入的机制涉及母胎界面的平衡打破,其中各种细胞和分子之间发生了复杂的相互作用。然而,关于这种病变的具体特征和其背后的分子机制,我们目前仍然知之甚少。

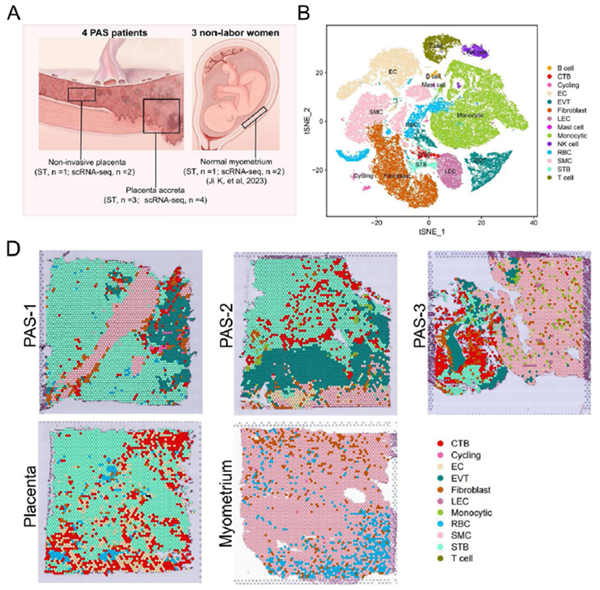
研究材料:四名PAS患者的组织样本,包括胎盘植入处组织(STRNA-seq,n=3;ScRNA-seq,n=4),非侵袭性正常胎盘组织(STRNA-seq,n=1;ScRNA-seq,n=2);三名健康足月孕妇的正常子宫肌层组织(STRNA-seq,n=1;ScRNA-seq,n=2)
研究方法:STRNA-seq、ScRNA-seq、免疫荧光染色

PAS组织中的细胞组成和定位
作者通过对胎盘植入处组织(PAS)、非侵袭胎盘和正常子宫肌层进行ScRNA-seq和STRNA-seq,获得了包括三种滋养层细胞在内的14种细胞亚群。其中三种滋养层细胞:包括绒毛外滋养层细胞(EVT),合胞体滋养层细胞(STB)和细胞滋养层(CTB)。通过整合空转和单细胞的结果,发现在侵袭性组织中,平滑肌细胞(SMCs)和三种滋养层细胞类型在空间上存在密切关系。
PAS组的滋养层细胞异质性和差异表达基因
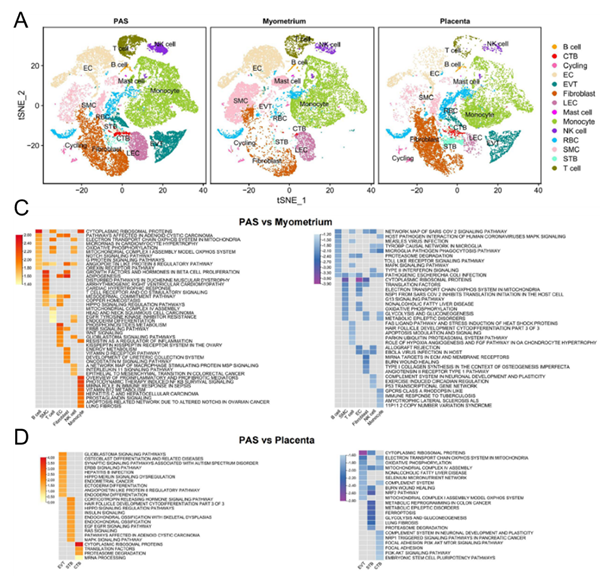
与非侵袭胎盘组相比,PAS的滋养层细胞在构成上呈现出显著不同,具体表现为EVT的丰度更高,而STB的丰度则相对较低。通过GSEA分析进一步发现,PAS组中的三种滋养细胞的功能发生显著变化:EVT内ERBB和血管生成素通路显著激活,但有氧呼吸途径受到抑制;STB中EGFR和RAS信号通路增强,而铁死亡相关过程减弱;CTB则表现为局灶黏附和PI3K-AKT通路下调。这些变化凸显了PAS中不同滋养细胞亚型特有的调控变化。
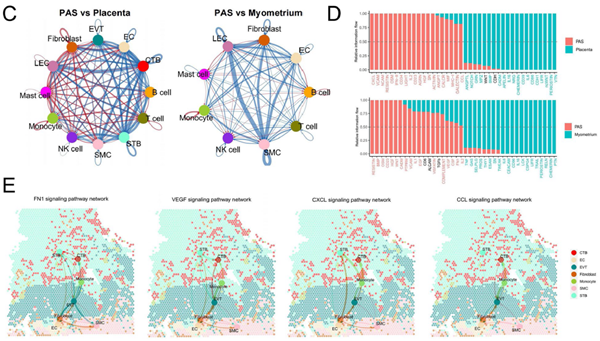
PAS中细胞通讯的特点
相比非侵袭胎盘组,PAS中滋养层细胞与免疫细胞的互作减弱,且SMC与多数细胞(除单核细胞和肥大细胞)的互作也减弱。PAS中炎症相关基因显著变化,表明抗炎与促炎机制间出现新平衡。同时,涉及细胞生长、增殖、血管生成和存活的基因在PAS中上调。
在PAS的空间分布上,FN1通路相关的细胞通讯主要涉及EVT、SMC和成纤维细胞,影响增殖、迁移和侵袭。VEGF相关的通讯集中于EVTs周围。在CCL和CXCL通路中发现EVT、CTB、成纤维细胞和SMC可能促进PAS的侵袭性。此外,三种滋养层细胞与免疫及成纤维细胞间的相互作用显著增强。
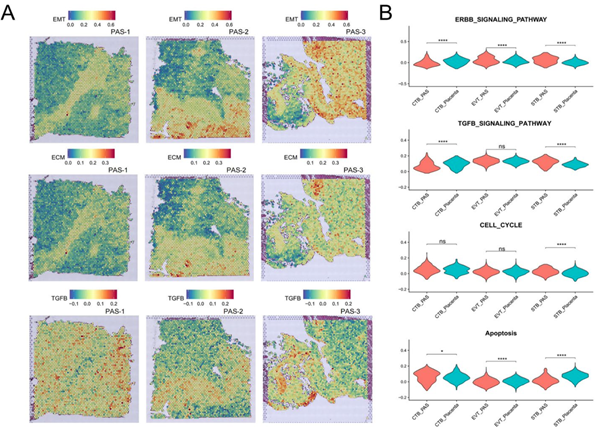
PAS滋养细胞中侵袭相关基因表达变化
通过STRNA-seq数据,作者发现TGFB作为入侵的关键通路主要富集于EVT中,但其表达水平并未发生显著变化。但在PAS组的STB中,与TGFB相关的基因和细胞增殖基因EGFR的表达均上调,结果表明EGFR有可能成为PAS治疗的一个潜在靶点。作者还发现 PAS 的滋养层细胞能够细分出正常组织所不具有的EVT4亚型,该亚型高表达PRG2,这与之前的报道相一致。
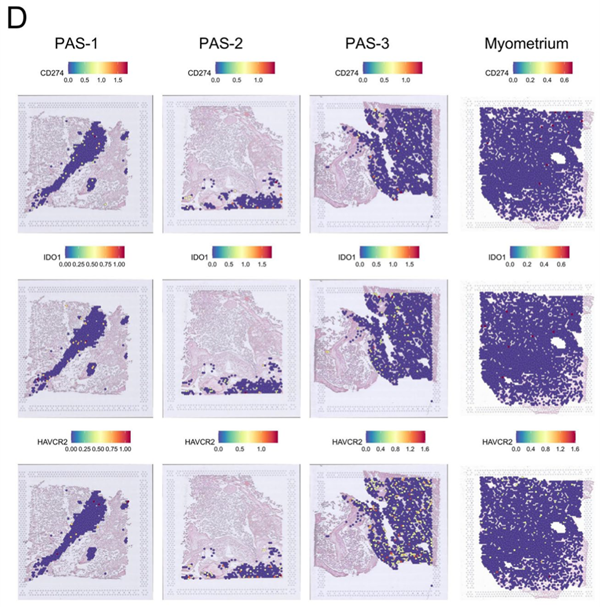
PAS中免疫细胞和炎症因子的变化
作者通过STRNA-seq分析,发现PAS的SMC区域显示较高的炎症反应和细胞因子水平。其中,单核细胞是该区域最丰富的免疫细胞类型。在PAS组中,中性粒细胞和APOE+巨噬细胞的数量显著增加,并且表达高水平的促炎因子。此外,作者还发现CXCL8+T细胞仅在PAS组中存在。
与正常子宫肌层组织相比,PAS的SMC区域中表达了一系列免疫抑制的标记基因,如IDO1、CD274和HAVCR2。作者进一步通过免疫荧光实验证实了这些基因在PAS SMC区域的高表达。
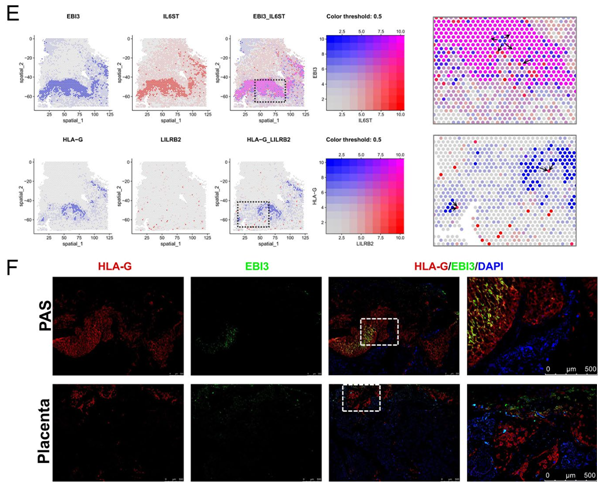
免疫耐受因子HLA-G和EBI3在PAS中的表达情况
在PAS侵袭过程中,免疫耐受因子HLA-G和EBI3(IL-35)在PAS侵袭的滋养层细胞中的表达增加,尤其在EVT中显著。STRNA-seq分析显示,HLA-G和EBI3在空间上共定位。EBI3的受体IL6ST主要在基质细胞和滋养层细胞中表达,与EBI3共定位;HLA-G的受体LILRB2则由单核细胞表达,并与HLA-G位置相近,免疫荧光实验也证实了这一结果。这种空间上的紧密相邻使得免疫抑制信号的传递更为有效。

该研究深入探索了PAS微观环境内侵袭区域肌层的基因表达情况,聚焦于EVT、CTB和STB在空间分布上的转录表达变化。研究结果显示,PAS中的滋养细胞、SMC以及免疫细胞中的基因表达差异,主要与免疫和炎症相关,特别是滋养细胞中PTK2和EGFR的表达升高。在PAS中的滋养细胞中,免疫抑制基因HLA-G和EBI3的表达也显著增强,同时免疫抑制基因显著增强,如CD274、HAVCR2和IDO1。首次揭示了PAS滋养细胞促进免疫耐受及肌层免疫抑制增强的现象,为PAS的发病机制和诊断治疗策略提供了新见解。