“相分离”描述的是一种细胞里不同成分间相互碰撞、融合形成液滴,从而使一些成分包裹在液滴内,一些成分被阻隔在液滴外的现象。许多蛋白质通过“相分离”行使功能,来维持机体正常的生命活动。“相分离”异常的蛋白质会导致功能异常,从而导致机体产生病变。近日华中科技大学同济基础医学院孙书国课题组在Molecular Cell(IF:15.584)发表了研究成果“Interferon-gammainduces tumor resistance to anti-PD-1 immunotherapy by promoting YAP phase separation”,该项研究对肿瘤的耐药性进行了探究,发现干扰素IFN-γ能够介导转录因子YAP相分离,YAP核相分离最终导致出现免疫治疗耐受性。其中,安诺优达为本研究提供了转录组测序服务。

研究亮点
1) IFN-γ在anti-PD -1治疗后促进肿瘤细胞YAP凝聚
2) 超螺旋结构域介导的疏水相互作用引发了YAP缩合
3) YAP凝聚物形成转录枢纽,提高靶基因的表达
4) YAP相分离介导anti-PD -1免疫治疗耐药性
研究结果
01 肿瘤细胞IFN-γ信号介导YAP点状物的形成(IFN-γ功能鉴定)
在小鼠肺癌模型中发现抗PD-1治疗具有终点耐药性,并伴随出现了YAP斑点;通过CRISPR-Cas9基因组编辑技术构建了IFNGR1敲除细胞系。将抗PD-1治疗后的INFGR1肿瘤细胞注射到C57B/6小鼠的皮下,在没有IFN-γ信号的情况下,抗PD-1治疗后不能形成YAP核斑点(图1F)。与此相一致的是,当肿瘤模型TDCL细胞移植到IFN-γ突变小鼠上时,抗PD-1治疗后,无法形成YAP斑点(图1G)。
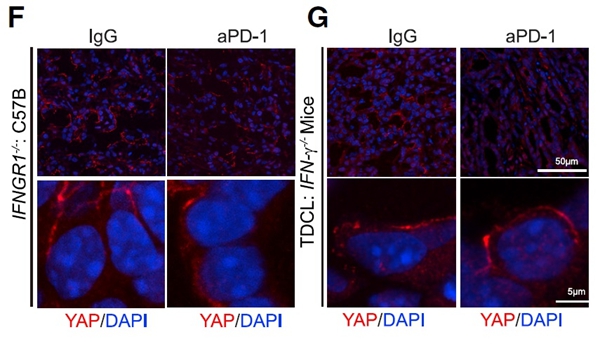
图1. IFNGR1 TDCL细胞移植至C57B/6小鼠的肿瘤冷冻切片[1]
02 超螺旋(CC)域和IDR驱动YAP相分离(相分离结构形成原因)
YAP c端包含一个预测的CC结构域和一个转录激活结构域(TAD)(图2A)。将C-IDR划分为CC、short IDR(sIDR)和short TAD(sTAD),在细胞中表达这些缺失结构以观察凝析物的形成。CC缺失完全阻断了斑点的形成,而sIDR缺失导致了更小的斑点的形成。相比之下,sTAD缺失不影响斑点的形成(图2B-2D)。这些结果表明YAP相分离需要CC和sIDR。如预期的那样,这三个缺失均导致了YAP靶基因的下调(图2E),表明YAP的转录功能需要YAP相分离相关域。CC结构域中的4个Leu疏水残基能够完全阻断了YAP的相分离。综上所述,YAP相分离是由cc介导的疏水相互作用引发,由sIDR的弱相互作用形成的。
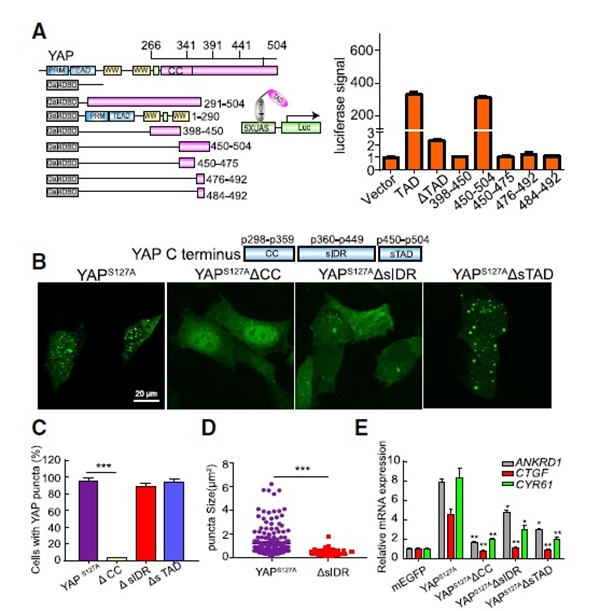
图2. 超螺旋结构(CC)域和IDR驱动YAP相分离[1]
03 YAP凝聚物是靶基因转录枢纽
在YAP凝结水(相分离结构中)中,H3K27ac水平与邻近地区相比升高(图3B)。为了检测YAP相分离是否也影响其调控区域的H3K27ac水平,进行了染色质免疫沉淀(ChIP)。发现YAP相分离中的缺陷减少了近端区域Myc H3K27ac的修饰(图3C)。接下来,利用qRT-PCR检测YAP靶基因的表达,许多靶点如Cdk6和Myc表达水平显著下调(图3D)。总的来说,YAP与多个组分相分离,形成一个转录中心,实现靶基因转录(图3G)。
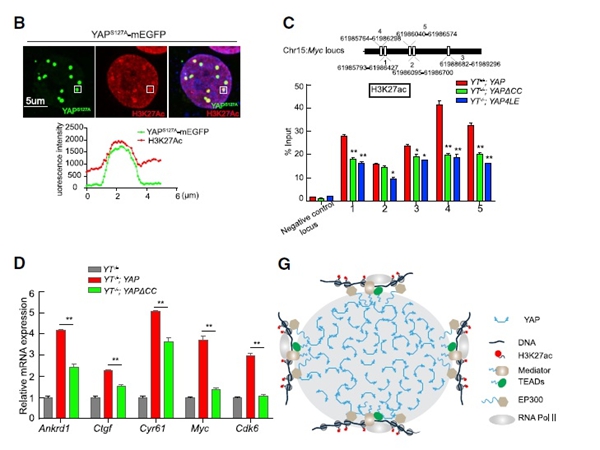
图3. YAP凝聚物是靶基因转录枢纽[1]
04 YAP相分离的破坏增强宿主免疫攻击和致敏抗PD-1治疗
为了评估YAP凝聚物的免疫功能,首先比较了完整的YAP和YAP相分离缺陷细胞系在小鼠中的肿瘤生长,发现相分离缺陷使肿瘤细胞对免疫控制更加敏感(图4A)。
使用RNA测序和qRT-PCR比较了IFN-γ刺激后YAP和缺陷细胞系的转录谱。结果表明,许多已知的YAP靶基因被下调(图4G和4H)。荧光素酶(Luc)报告基因实验结果显示,破坏YAP相分离或敲除YAP会抑制Luc的表达,表明CD155是YAP的直接靶点,是由YAP相分离驱动的(图4J、4K)。之后将CD155 RNAi细胞株移植到C57B/6小鼠皮下,并用抗PD-1或IgG处理。结果显示,抗PD-1治疗进一步缩小了RNAi组的肿瘤大小(图4M)。同样,对肿瘤切片的IF和H&E分析显示,两种RNAi细胞系中CD8+细胞浸润增加(图4N)和坏死(图4O)。
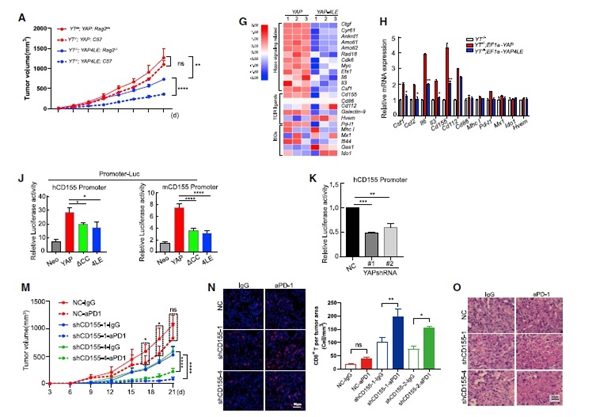
图4. YAP相分离的破坏增强了肿瘤免疫编辑和致敏抗PD-1治疗
总结
干扰素-γ(IFN-γ)介导的抗适应性是改善实体肿瘤免疫治疗的一个主要障碍。本文本文研究发现在小鼠肺腺癌模型中,干扰素IFN-γ促进肿瘤细胞抗PD-1治疗后的核易位和YAP的相分离。YAP分离后与转录因子TEAD4、组蛋白乙酰转移酶EP300和Mediator1复合物形成转录中心,提高靶基因的转录。当破坏YAP相分离则会降低肿瘤生长,增强免疫反应,并使肿瘤细胞对抗PD-1治疗敏感。YAP活动与患者预后呈负相关。提示YAP可作为抗PD-1联合治疗的预测生物标志物和靶点。
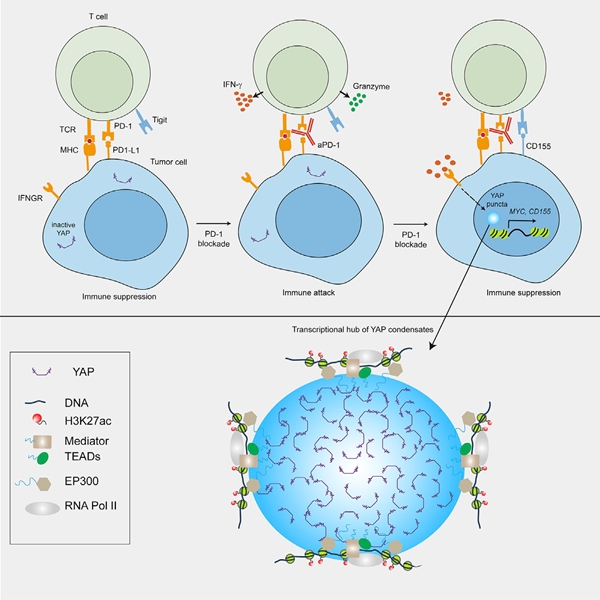
图5. 干扰素-γ通过促进YAP相分离诱导肿瘤anti-PD-1免疫治疗的耐药性示意图
参考文献:
Man Yu, Zhengxin Peng, Min Qin, et al. Interferon-g induces tumor resistance to anti-PD-1 immunotherapy by promoting YAP phase separation[J]. Molecular cell, 2021.


