HPV整合是宫颈癌发生的关键病因学事件。研究发现HPV在人类基因组中有许多高频整合位点,例如8q24.21和13q22.1,并且在宫颈癌细胞系和临床样本中的相关研究已经表征了这些位点上的HPV整合会引起三维基因组变异[1]。但这些变异都是细胞经过长期克隆选择压力后的终产物,HPV整合诱导细胞癌变的动态过程中,哪些基因在整合早期响应并参与基因组不稳定的积累过程却很难知晓。因此,建立一种能够维持有限的细胞分化和上皮细胞表型特征的HPV敲入细胞模型,有望重现HPV整合诱导细胞内基因组不稳定事件的动态过程,进而阐明HPV整合诱导宿主细胞癌变的内在机制。
近日,华中科技大学同济医学院附属同济医院的汪辉教授团队在Journal of Advanced Research上发表了文章“PIBF1 regulates multiple gene expression via impeding long-range chromatin interaction to drive the malignant transformation of HPV16 integration epithelial cells”。安诺优达为该研究提供了Hi-C及多组学建库测序分析服务。

研究团队构建了一个13q22位点定点敲入HPV16 E6E7基因的细胞模型,来探究HPV整合早期细胞和分子层面的响应。该研究发现HPV整合事件破坏了宿主基因组三维结构,造成PIBF1(progesterone-induced blocking factor 1)基因的表达上调,并且用严谨的实验证实了PIBF1的失调可能通过反式作用调节染色质结构。具体而言:PIBF1通过与cohesin互作的方式,破坏cohesin的环状结构,进而减少染色质环(loop)的形成,loop的消失会导致肿瘤发生相关基因的失调。
文章发表在Journal of Advanced Research研究团队发现,HPV16 E6E7基因敲入(KI)之后对HaCaT的细胞生物学行为产生了深远影响:KI细胞比对照细胞生长得更快,并且促进了侵袭和迁移能力。裸鼠成瘤实验显示,对照细胞形成表皮囊肿并最终完全停止生长,而KI细胞在观察期内保持增殖活力,并在其异种移植物中检测到单克隆增殖。这表明高频整合位点定点敲入HPV16癌基因确实可诱导细胞发生恶性生物学行为。
外源DNA的整合会导致基因组结构的改变,该研究观察到KI细胞的三维基因组也对应发生了改变:由于HPV16癌基因的敲入,敲入位点所在的TAD被HPV16明显的分割成两个子结构域,附近的compartment的分隔也更精细。
研究团队观察到敲入位点所在的TAD内的PIBF1基因表达明显上调。PIBF1有其经典的功能,但研究团队重点关注其具有广泛的染色体结构维持(SMC,structural maintenance of chromosomes)结构域。SMC1、SMC3与RAD21相互作用形成cohesin环状蛋白复合物参与loop的形成在三维基因组领域被广泛认知[2],因此,PIBF1先被假设能够与cohesin结合,或替换某个SMC亚基并参与loop形成,CUT-Tag实验帮助研究团队第一次通过高通量的方式观察到PIBF1具有DNA结合特性(此前仅有一篇报道从PIBF1 ChIP文库中用PCR扩增数个peak的研究[3]),但是其DNA结合位点与CDB(contact domain boundary)、RAD21以及SMC3的DNA结合位点几乎没有交集,说明PIBF1与cohesin一起参与loop调控基因表达的初步假设是不成立的。
Western blot、蛋白质谱和免疫荧光实验证实了PIBF1能够与cohesin复合体结合,基于他们在DNA上的结合位点不重合的信息可推断:PIBF1与cohesin的结合在染色质之外的位置。到这里进一步的猜想就是:高表达的PIBF1是否通过互作结合的方式消耗了部分cohesin,使基因组上某些本该形成loop的位置因为cohesin的缺少而不能正常调控。
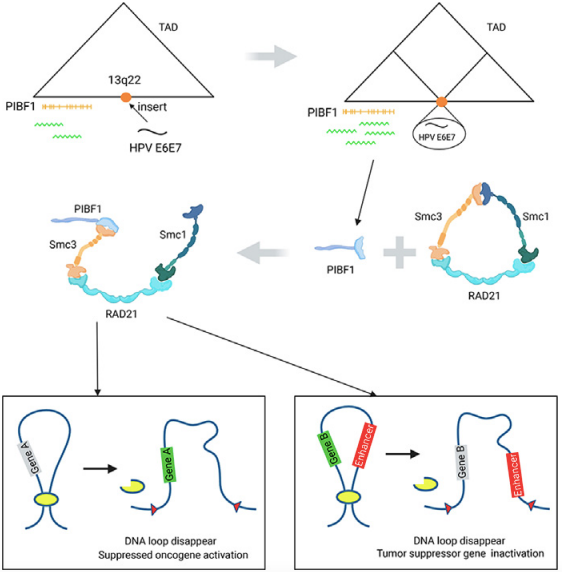
后续探索确实发现PACSIN1和HSD11B1等癌症相关基因的表达受到loop消失的影响而失调,并且在KI中抑制PIBF1表达之后,PACSIN1和HSD11B1的表达恢复正常。进一步实验发现,KI细胞中PIBF1的敲减抑制了细胞的增殖、侵袭和迁移能力,并且通过下调PIBF1的表达抑制了HPV16在13q22位点整合阳性宫颈癌细胞系SiHa的裸鼠皮下成瘤能力。
以审稿人的评论作为总结:Overall, this is a strong manuscript, where the Authors use a novel experimental approach to investigate HPV16 integration in cervical transformation. They are thorough in confirming that the integration leads to transformed phenotypes in vitro and in vivo, and they hone in on a particular gene PIBF1. It is an interesting paper which opens many doors for future experimentation.
敲入HPV16癌基因后更长期的基因组变异和表型的观测以及其他整合位点的研究将为解读宫颈癌发生发展提供帮助。
华中科技大学同济医学院附属同济医院的汪辉教授为该研究通讯作者,丁文成教授为共同通讯作者,李晓敏博士为第一作者,任慈博士、硕士生黄安妮为论文共同第一作者。安诺优达苑赞为共同通讯作者,博士后王黎明等参与了这项研究。
[1] Groves I J, Drane E L A, Michalski M, et al. Short-and long-range cis interactions between integrated HPV genomes and cellular chromatin dysregulate host gene expression in early cervical carcinogenesis[J]. PLoS Pathogens, 2021, 17(8): e1009875.
[2] Uhlmann F. SMC complexes: from DNA to chromosomes[J]. Nature reviews Molecular cell biology, 2016, 17(7): 399-412.
[3] Halasz M, Polgar B, Berta G, et al. Progesterone-induced blocking factor differentially regulates trophoblast and tumor invasion by altering matrix metalloproteinase activity[J]. Cellular and molecular life sciences, 2013, 70: 4617-4630.

