2023年7月,昆明理工大学李天晴教授、季维智教授及Ai Zongyong在Cell Research(IF=44.1)上发表了题为“Dissecting peri-implantation development using cultured human embryos and embryo-like assembloids”的文章。该研究利用3D培养的胚胎,绘制了人围着床胚胎的完整细胞图谱,定义了不同细胞谱系及其互作关系,破译了外胚层和下胚层衍生物的细胞组成和基因特征,并成功构建了一种新的胚胎模型——人胚胎样组装体(E-assembloid)。安诺优达为本研究提供了转录组建库测序、甲基化建库测序和10x单细胞测序服务。
01 研究背景
体外人胚胎培养系统的开发,成功将人囊胚的生长的研究扩展到前原肠胚期。然而,人围着床期发育过程中的精确细胞图谱、谱系规范和发育信号,特别是与HB和EPI衍生物相关的信号仍不清楚。尽管已有研究表明,人囊胚样结构是由人多能干细胞(hEPSCs)或引物调节性中间物或重编程成纤维细胞产生的,但着床期胚胎一些重要的三维组织结构,在扩展培养的人囊胚中并不能很好地再现。因此,研究胚胎围着床期发育具有重要的意义。
02 研究内容
3D培养人胚胎的单细胞转录图谱
利用单细胞转录组测序(scRNA-seq),研究者获取了3D培养人胚胎(E10-E14期)完整的细胞图谱。其中,以往研究中未被准确表征的着床后HB和EPI衍生物的相关细胞被准确注释出来。将滋养层细胞(TrB)剔除后,根据Marker基因特异性表达情况,进行了细胞亚簇的功能注释和参与谱系发育信号通路的推测。
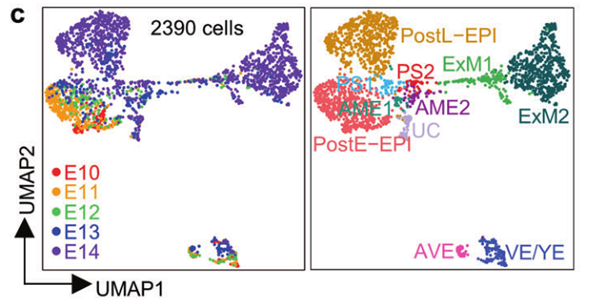
排除滋养细胞亚群后所有细胞类型UMAP的可视化结果(c)
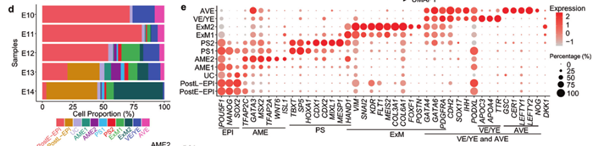
不同发育时期3D培养胚胎中包含的细胞比例(d)和各细胞亚簇中特异性候选基因的展示(e)
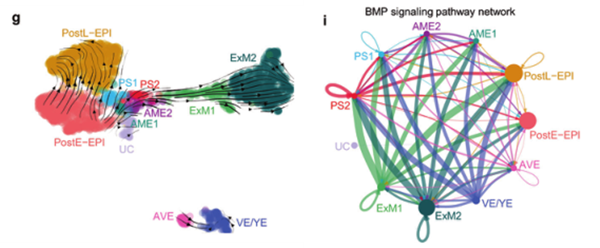
RNA速率分析亚簇间的分化关系(g)和细胞通讯分析推断BMP信号通路网络(i)
常氧(21% O2)下原始hESCs的获取
为了模拟胚胎着床后HB和EPI谱系的发育,使用未成熟的人多能干细胞(hPSCs)建立胚胎样细胞是关键步骤之一。通过建立新的AIC培养体系,研究者获取了和低氧诱导的原始hPSCs较为相似的常氧原始人胚胎干细胞(hESCs)。经转录组测序和甲基化测序验证,AIC-N hESCs在多能性标志物、转录组(mRNA基因表达)、甲基化水平和分化为胚胎和胚胎外谱系的潜能方面,保留了相似的多样性。
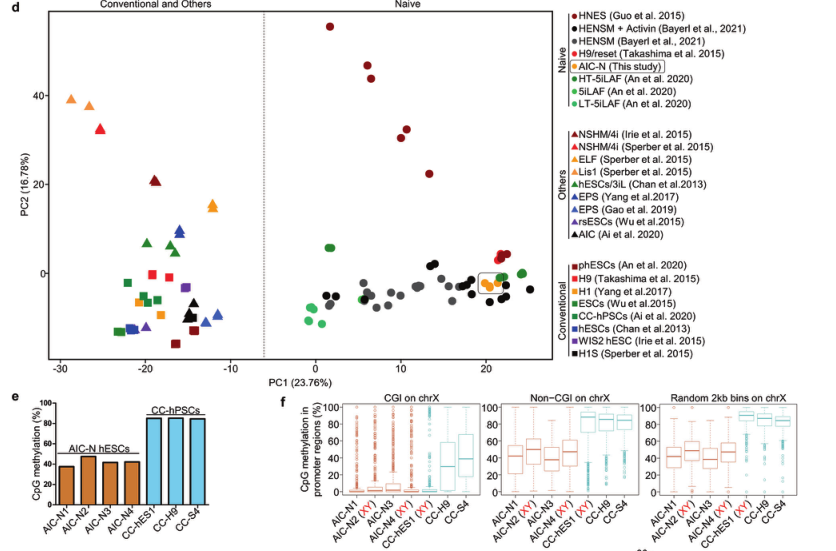
不同生长条件下hPSCs基因表达谱的主成分分析(d)AIC-N hESC细胞系和CC-hPSC细胞系的全基因组CpG甲基化水平比较(e)
WNT、BMP信号通路的关键作用和E-assembloid的改良
研究者初步构建了将SNCs与原始hESCs整合的胚胎样组装体(E-assembloid,以下简称E-组装体)。SNCs表达WNT和BMP配体,其诱导信号驱动E-组装体的发育。使用化学抑制剂抑制WNT和BMP通路,发现E-组装体培养过程中人胚外中胚层(extraembryonic mesoderm,ExM)、原条(primitive streak,PS)和羊膜上皮(amniotic epithelium,AME)的发育受到抑制。形成ExM需要WNT和BMP信号,它们也是PS和AME发育所必需的。AIC-N hESCs向类胚外内胚层细胞(XEN-like cells,XENLCs)的分化需要依照节点短时间内将两条通路协同激活。
因此,研究者通过调节信号通路重新对E-组装体进行了改良。进一步将3D培养人胚胎(以下简称3D胚胎)和E-组装体进行单细胞转录组比较分析,发现D8 E-组装体在细胞谱系组成方面与E13/14胚胎相似;3D胚胎和E-组装体中的谱系和信号调节基因的表达模式非常相似;3D胚胎和E-组装体中可能都存在初始造血。这表明,E-组装体成功再现了原肠胚形成前人胚胎的外胚层和下胚层发育的组织结构。
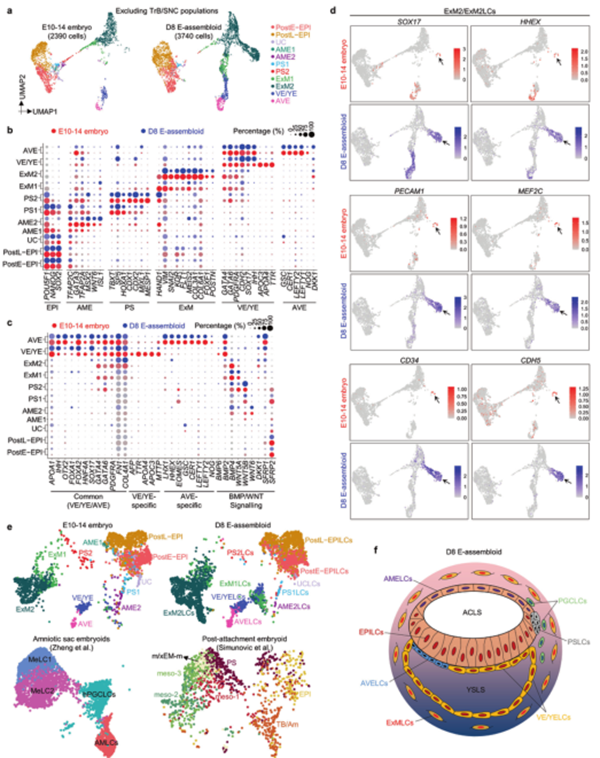
E-组装体和3D胚胎的单细胞转录水平的比较
03 研究结论
本研究构建了一个完整的人围着床期胚胎的单细胞转录组图谱,对XEN和ExM标记进行了鉴定,为今后人胚胎模型和胚胎/胚胎外谱系的体外研究提供了重要资源。同时,E-组装体的建立,概括了人原肠胚形成前EPI和HB衍生物的发育特征和3D结构,系统揭示了人围着床胚胎的谱系多样化、信号作用和组织模式,为日后解开驱动人胚胎发生的细胞行为和相互作用提供了全新的模型。
04 参考文献
Ai, Z., Niu, B., Yin, Y.et al. Dissecting peri-implantation development using cultured human embryos and embryo-like assembloids. Cell Research (2023). https://doi.org/10.1038/s41422-023-00846-8

